肿瘤标志物案例2.免疫相关性肾上腺皮质功能减退症1例
前言
随着医学水平的不断进展,许多恶性肿瘤的免疫治疗时代已经开启,随着 日益增多的免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)的临床应用, 越来越多的治疗相关不良事件被临床医师所观察到。免疫相关不良事件 (immune related adverse events,irAEs)是与免疫检查点抑制剂相关的自身免疫毒性 作用所致的疾病,有研究表明,免疫相关不良事件与免疫检查点抑制剂的临床 获益相关,其发生、发展与治疗的反应持续时间及疾病预后等均有相关性。以 下介绍本院一例免疫检查点抑制剂相关的肾上腺皮质功能减退症的案例。
案例经过
简要病史:患者为35岁青年男性,诊断为:左手背皮肤黑色素瘤复发术后 双肺、左腋窝淋巴结转移;慢性乙型病毒性肝炎。
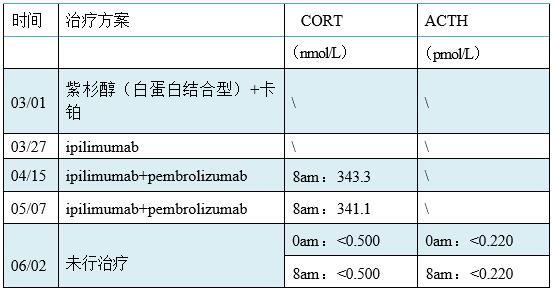
在日常审核报告时, 发现本案例患者8 am皮质醇为
患者06月01 日入院复诊, 拟行第3程ipilimumab+pembrolizumab方案治疗, 患者精神一般, 自诉2周前出现头痛、乏力, 但可自行缓解。予06月02日查 CORT :0am 、 8am均
案例分析
临床案例分析:
(1)危急病情的判断及处理:一般认为血浆皮质醇基础值≤3µg/dl可确诊为 肾上腺皮质减退症,对于本案例的患者皮质醇
(2)为进一步评估患者治疗疗效及病情,进行了以下辅助检查:
6日1 日: 胸部、上下腹部、盆腔CT: 左手腕恶性黑色素瘤治疗后, 与 2015-03-30结果对比:原双肺多发结节, 较前明显缩小变少。左侧腋窝条索影增 多,考虑术后改变。左侧腋窝小结节,建议随诊复查 ;盆腔未见明显异常 ; 甲 状腺及颈部淋巴结彩超:甲状腺、颈部未见明显占位性病变。
6月2日:颅脑MR+增强: 黑色素瘤复查, 与2-27对比: 垂体结节, 大小约 13mm×17mm×8mm,较前为新增,考虑转移瘤可能性大,建议随诊。左侧小脑 近小脑幕条状异常信号,较前无明显变化,余颅脑未见明确病变。
(3)鉴别诊断: 根据以上辅助检查, 未见下丘脑病变, 需进一步区分鞍区肿 瘤:垂体瘤?黑色素瘤转移瘤?还是免疫相关性垂体炎?
①影像学上提示有新发垂体瘤的可能,但功能性垂体瘤往往表现为垂体功 能激素分泌的亢进, 最常见是PRL 、 HGH异常升高, 而该患者仅有皮质醇与 ACTH的异常,因此可能性不大。
②患者有黑色素瘤病史,查阅相关文献知黑色素瘤被认为是最具嗜中枢性 的肿瘤之一,脑转移高达10%~40%。但黑色素瘤脑转移一般呈现为多发性, 影像上垂体占位为单一病灶,且垂体转移瘤以尿崩与视觉损害为首发临床表现 的占绝大多数[1],与案例患者病情不相符。
③患者已行ipilimumab+pembrolizumab免疫治疗2程,已有大量文献明确指 出经CTLA-4抑制剂治疗后的患者近乎100%会表现出肾上腺皮质功能减退和甲 状腺功能减退,且最常影响的是肾上腺皮质轴,其次是甲状腺轴及性腺轴, 生 长激素减少的情形较少见。
(4)临床诊断及治疗: 患者为35岁青年男性, 为恶性黑色素瘤晚期患者, 已 经没有取脑组织病理诊断的必要,因此对临床的诊断带来了很大的困难。根据 患者使用抗CTLA-4单抗Ipilimumab + 抗PD- 1单抗Pembrolizumab方案治疗后2月 内出现皮质醇下降,综合考虑诊断为免疫相关垂体炎继发肾上腺皮质功能减退 可能性大, 予暂停单抗治疗, 经静脉氢化可的松治疗, 以纠正糖皮质激素缺乏, 复查患者血生化,尿常规等项目指标大致正常,患者乏力,疲倦,头痛的症状 完全缓解,治疗有效,予出院带药泼尼松继续口服替代治疗。
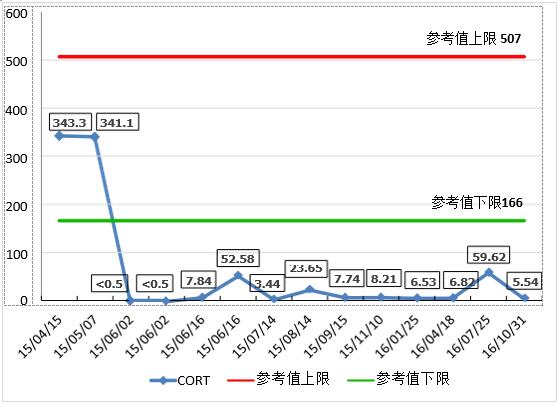
后续追踪患者病情,患者原双肺多发结节,较前明显缩小变少,垂体病灶 较前缩小,患者长期口服强的松替代治疗,但患者肾上腺皮质功能并未恢复, 可见图1 。
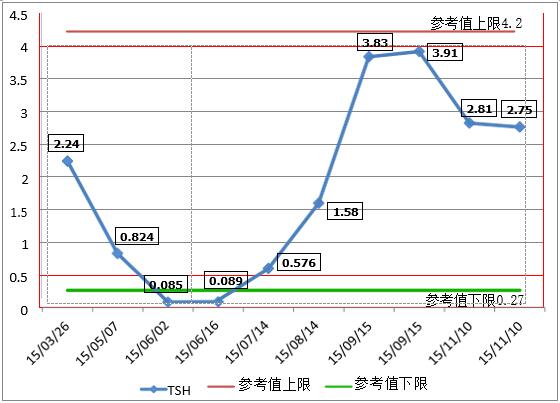
免疫检查点抑制剂(immune checkpoint inhibitors ,ICIs)已成为包括黑色 素瘤等多种癌症的 标准治疗方法。该 患者为晚期黑色素 瘤,行 2 程 ipilimumab+pembrolizu-mab方案治疗后出现免疫相关肾上腺减退, 而在检验相 关检查中, 我们可看到患者ACTH及皮质醇均下降, 而本文案例中, 患者性别, 年龄,发病时间,临床表现及检验检查等与文献所报道的免疫抑制剂治疗后所 致的免疫相关性垂体炎(immunotherapy induced hypophysitis ,IH) 相符合。有 研究发现促甲状腺激素(stimulating hormone ,TSH)经常在IH诊断确认或临床症 状出现前就开始减低, 并可进展至明显的中枢性甲减,这就可以解释患者甲功 仅TSH降低的原因(TSH变化趋势见图2)。
检验案例分析:
(1)当天的仪器状态、试剂均无异常, 质控通过, 且其他标本结果亦未见异 常,可排除系统误差的影响,进一步查询患者病史,了解患者检验结果是否与 临床相符。
(2)由于激素的分泌是有节律性的, 不同性别、不同年龄、不同生理周期、 妊娠等正常生理情况下会不在参考区间内,因此在选择医嘱和抽血及后续分析 结果时,要充分考虑生理因素及个体生物学变异对项目结果的影响。皮质醇、 促肾上腺皮质激素的分泌存在明显的昼夜节律, 因此一般采取0am及8am两个时 间点检测其分泌的节律性。为此,与临床沟通后,明确患者的采集时间点, 确 定了4月15日、5月7日采集标本的时间点均为8am,而6月2日采集标本的时间点 分别为0am和8am, 且标本状态、使用的抗凝剂均符合要求,因此与以往结果是 具有可比性的。
(3)患者的肾上腺皮质减退是哪一种原因导致的呢? 一般以病因可分为原发 性及继发性,当表现为皮质醇减低,而ACTH升高时,考虑为原发性肾上腺皮质功能减退; 当皮质醇和ACTH均减低时, 考虑是继发性肾上腺皮质功能减退, 该患者皮质醇及ACTH均低于检测限,考虑患者为继发性肾上腺皮质减退,该 病最常见于长期应用超生理剂量的糖皮质激素,也可继发于下丘脑-垂体疾病, 如鞍区肿瘤、自身免疫性垂体炎、外伤、手术切除、产后大出血引起垂体大面 积梗死坏死(席汉综合征)等。但患者无长期用糖皮质激素、无外伤、近期无 手术等病史,那么患者存在下丘脑-垂体疾病从而导致肾上腺皮质功能减退的可 能最大。
至此,我们可以判断该患者6月2日出现皮质醇结果与历史结果差异较大, 与该患者用ICIs治疗所致垂体炎相关,该检验结果符合临床及病人病程进展, 且经过追踪患者病情后,患者病情变化符合免疫相关垂体炎(继发肾上腺皮质 功能减退)诊断。
知识拓展
随着免疫检查点抑制剂的广泛应用 ,其导致的irAEs也越来越受到重视 ,其中 内分泌相关不良事件(如甲状腺功能障碍、垂体炎、肾上腺功能不全等)起病时 表现隐匿,不易被发现 , 导致治疗延误 ,往往带来严重不良后果甚至危及患者生命。 本文重点对免疫检查点抑制剂诱导的垂体炎(immunotherapy inducedhypophysitis , IH)进行介绍。
(1)发生率及临床表现
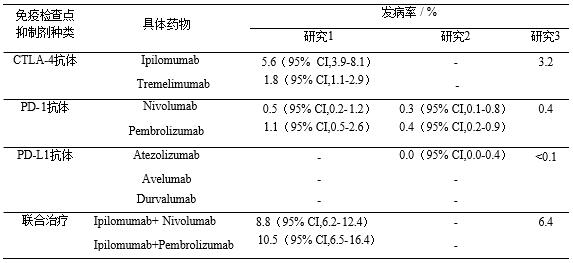
引起的垂体炎通常发生在接受 Ipilimumab 治疗的患者当中,且患者常为年 龄偏的男性,平均年龄为63岁,表现为全垂体功能减退或垂体前叶功能减退, 伴或不伴垂体增大(在影像学上,50%以上的垂体炎患者在垂体增强核磁共振 成像上表现为垂体的弥漫性增大),一般很少出现与垂体占位相关的一些症状 [2]。一项回顾性研究报道,Ipilimumab 引起的垂体炎最常见的症状是头痛和疲 劳[3]。其他罕见症状包括神经精神症状(意识模糊、幻觉、记忆力减退和情绪 波动)、视觉障碍、失眠、厌食、恶心、腹泻、畏寒、寒战、勃起功能障碍和 性欲减退等[4]。由于上述症状都不具典型性, 所以临床上往往会被误认为与原 发病或者其他疾病相关而出现漏误诊。因此, 在开始ICIs治疗前, 进行TSH 、 FT3 、FT4 、ACTH、清晨皮质醇、IGF- 1、电解质和葡萄糖等基线水平的评估是有必要的。当患者出现提示垂体炎的症状时, 需要在每个治疗周期之前都进行 系统的激素评估[3]。在晚期黑色素瘤患者中,接受Ipilimumab、抗 PD- 1 单抗以 及Ipilimumab 和 Nivolumab 联合治疗的患者,发生垂体炎的中位时间分别为2-4 个月、3.3-5.5 个月和 2.7 个月[5],常见于免疫检查点抑制剂3次治疗后。据文献 报道,CTLA-4 抑制剂、PD- 1 抑制剂和 PD-L1 抑制剂在单药治疗时,垂体炎的 发生率分别为 3.2 %、0.4 %和小于 0.1 %,而两药联合(Nivolumab 和 Ipilimumab) 治疗时其发生率最高, 为6.4%[6], 多项关于IH发病率研究图3 。 Ipilimumab相关性垂体炎的毒性特征表现为剂量依赖性[7]。最近一项 III 期临床 试验证实,Ipilimumab 相关性垂体炎的发生率高剂量组(10mg/kg) 是低剂量组 (3mg/kg) 的两倍, 分别为 6.6%和 3.3%[8]。根据疾病的严重程度,IH被分为 1-4级(1级: 无症状或轻度症状;2级: 中度症状, 日常活动不受限;3级:重 度症状,影响日常活动;4级:严重症状,危及生命,不能进行日常活动)[9] 。
(2)发病机制
Ipilimumab 相关性垂体炎的发病机制目前仍不十分清楚。据文献[10]报道, 在小鼠垂体内分泌细胞上发现了 CTLA-4 的表达。试验人员通过给小鼠反复注 射抗CTLA-4抗体建立小鼠模型, 当CTLA-4抗原抗体结合时, 通过补体依赖的 细胞毒性作用攻击垂体内分泌细胞, 引起小鼠继发性垂体炎。研究人员还发现, CTLA-4 除 了 在 小 鼠 垂 体 内 表 达 , 在 人 类 的 垂 体 中 也 有 表 达 , 这 可 能 是Ipilimumab 相关性垂体炎发生的毒性机制。
(3)毒性管理
IH的治疗需要考虑是否停用免疫检查点抑制剂和受累的下丘脑-垂体轴的激素替代治疗两个方面。对于1-2级IH,建议继续免疫检查点抑制剂的治疗,以免 影响原发肿瘤的治疗效果。对于3-4级IH患者因多合并垂体危象 , 需要中断治疗 并给予激素替代治疗, 同时评估垂体轴的功能, 行垂体核磁检查以除外脑转移, 并请内分泌科医师协助治疗。
目前, 大剂量糖皮质激素冲击治疗在IH应用中存在争议,早期研究认为初 始治疗策略应该包括用大剂量糖皮质激素(约1mg/kg泼尼松或等效物)的冲击治 疗[11], 但是近年研究证明在患有Ipilimumab单抗诱发的垂体炎的黑色素瘤患者 中接受大剂量糖皮质激素治疗会降低患者的生存率[12], 并且大剂量糖皮质激素 治疗并不能显著改善垂体前叶功能减低[8], 因此, 不推荐大剂量的糖皮质激素 治疗。IH患者需要长期的激素替代治疗, 因激素替代治疗后其继发性肾上腺功 能不全未能痊愈, 仍需长期激素替代[13]。若患者存在头痛或其他神经精神系统 症状,则需给予大剂量皮质类固醇激素治疗, 头痛患者可给予对乙酰氨基酚对 症止疼治疗。
案例总结
临床案例总结
近年来ICIs在肿瘤患者广泛使用, 导致的内分泌系统损伤的情况越来越多 见, 因此在患者明确诊疗方案后, 应及时评估患者内分泌相关激素的基础水平, 在治疗过程中对已经发生免疫相关irAEs及时诊断, 并对疾病的严重程度进行分 级,继而进行对症治疗,减轻患者在治疗过程中的痛苦。在治疗用药方面, 应 该加强对药物的药理、作用机制的学习,才能更好的让患者在治疗过程中获益 最大。
检验案例总结
近年来免疫检查点抑制剂在晚期恶性肿瘤患者中的应用取得了很大进展, 其所诱导的自身免疫性垂体炎也逐渐受到关注, 因IH所致的垂体危象会导致生 命危险,因此早期识别IH甚至irAEs尤为重要。作为检验医师,首先要把好检验 前、检验中环节的质量, 保证内分泌检查数据(包括ACTH 、TSH 、FSH 、LH 、 GH 、PRL、皮质醇及甲状腺功能等等项目) 的准确性是分析这种异常案例的基 础。在检验后方面,关注病人的相关临床表现,分析治疗方案,了解药物治疗原理,综合生理和病理生理基础知识,抽丝剥茧,才能做到思路清晰,逐项鉴 别,最终得出准确判断。另外与临床医生就此种案例进行沟通,强化医生对激 素指标等方面进行定期、全方位的检验医嘱开具。检验与临床紧密联系与合作 才能及时准确地应对可能或已经出现的irAEs 。
专家点评:戴淑琴中山大学肿瘤防治中心主任技师
目前, 免疫治疗在肿瘤领域已取得重要的进展, 随着免疫检查点抑制剂 (ICIs)的广泛使用, 所出现的免疫相关不良事件也越来越多。本文介绍的是 因发现与历史结果差异较大的检验报告单所牵出的一例免疫相关性垂体炎 (IH),该案例患者经免疫治疗后出现肾上腺皮质功能减退, 并且复查头颅 MR时发现垂体新增结节,让临床的诊断更是蒙上了一片雾霾。但患者相关内分 泌检查指标相对完善, 结合患者免疫治疗的时间点及其他相关信息, 因此临床 医师能较早准确地诊断出IH,为患者后续的治疗提供了保障。
本文的案例分析部分已叙述详细,鉴别诊断理据充足,知识拓展部分亦为 临床诊断提供了有力的支持。除此之外,ICIs不良事件涉及的内分泌系统靶点 之多,不同案例的首发症状及异常指标也各不相同,包括性激素、IGF- 1、泌乳 素、甲状腺功能、皮质醇、ACTH等等指标出现的结果异常, 我们检验医师也 需增加自身知识水平, 拓展临床思路,紧跟科学的发展,多思考异常的检验结 果是否与疾病发展及用药相关。希望通过本案例的抛转引玉,能让以后的检验 工作更加结合临床,对患者的诊断及治疗有一定的帮助。
参考文献
[1]. laridiL R,EL SIBAI K,FU P,et al. Clinical and biochemical characteristic features of metastatic cancer to the sellaturcica:ananalytical review[J]. Pituitary,2014, 17(6):57 5-587.
[2]. Faje A T, Sullivan R, Lawrence D, et al. Ipilimumab-induced hypophysitis: a detailed longitudinal analysis in a large cohort of patients with metastatic Melanoma [J]. Journal of Clinical Endocrinology and Metabolism, 2014, 99(11):4078-4085.
[3]. Ihara K. Immune checkpoint inhibitor therapy for pediatric cancers:a mini rewiew of endocrine adverse events[J].Clin pediatr Endocrinol,2019,28(3):59-68.
[4]. Joshi M N.Whitelaw B C.Palomar M T,etal.Immune checkpoint inhibitor-related
hypophysitis and endocrine dysfunction: clinical review[J].Clinical Endocrinology. 20 16.85(3):331-9.
[5]. Barroso-Sousa R,Ott P A,Hodi F S,et al. Endocrine dysfunction induced by
immune checkpoint inhibitors: Practical recommendations for diagnosis and clinical management[J].Cancer,2018,124(6):1111-21.
[6]. Barroso-Sousa R.Barry W T.Garrido-Castro A C.et al.Incidence of Endocrine Dysfunction Following the Use of Different ImmuneCheckpoint Inhibitor Regimens: A Systematic Review and Meta-analysis[J].JAMA Onco1. 2017.4(2):173-82.
[7]. Feng Y.RoyA.Masson E.et al.Exposure-response relationships of the efficacy and safety of ipilimumab in patients with advanced melanoma[J]. Clinical Cancer Research. 2013.19(14):3977-86.
[8] Ascierto P A.Del Vecchio M,RobertC,etal.Ipilimumab 10 mg/kg versus ipilimumab 3 mg/kg in patients with unresectable or metastatic
melanoma:arandomised,double-blind,multicentre.phase 3 trial[J].Lancet Oncology. 2017. 18(5):611-22 [9]BrahmerJR,LacchettiC,and Thompson JA. Management of immune-related
adverse events in patients treated with immune checkpoint inhibitor therapy: american society of clinical oncology clinical practice guideline summary[J].Oncol Pract,2018.14:247-249.
[10]. Iwama S, De Remigis A, Callahan M K, et al. Pituitary expression of CTLA-4 mediates hypophysitis secondary to admi nistration of CTLA 4 blocking antibody[J]. Science Translational Medicine, 2014, 6(230):230ra45.
[11]. CorselloSM,BarnabeiA,Marchetti P.et al. Endocrine side effects induced by immune checkpoint inhibitors[J].J Clin Endocrinol Metab,2013.98: 1361- 1375.
[12]. FajeAT,LawrenceD,FlahertyK,etal.High-dose glucocorticoids for the treatment of ipilimumab-induced hypophysitis is associated with reduced survival in patients with melanoma[J].Cancer ,2018,124:3706-3714.
[13]. Min L,HodiFS,Giobbie-HurderA,etal.Systemic high-dose corticosteroid treatment does not improve the outcome of ipilimumab-related hypophysitis:a retrospective cohort study[J].Clin Cancer Res ,2015,21:749-755.
备注 该案例入选《中华医学会内分泌案例集》






