肿瘤标志物案例10.不再“沉默”的胃癌标志物-AFP
作 者:朱苑莹 初级技师 检验医学科
指导老师:戴淑琴 主任技师 检验医学科
说起AFP,我们常常会联想到原发性肝癌~那么我们一起来看看,在这个案例中,AFP是一个什么角色呢?在日常审核验单的时候,发现一份肿瘤标志物的报告中AFP:7659 ng/ml,我心想,这很有可能是原发性肝癌的患者嘛~于是我习惯性的看了患者的诊断,发现这竟然是一个胃癌患者的结果,胃癌患者的AFP这么高,而胃癌相关的指标如CEA,CA199,724却只是正常或轻度升高,这到底是为什么呢?
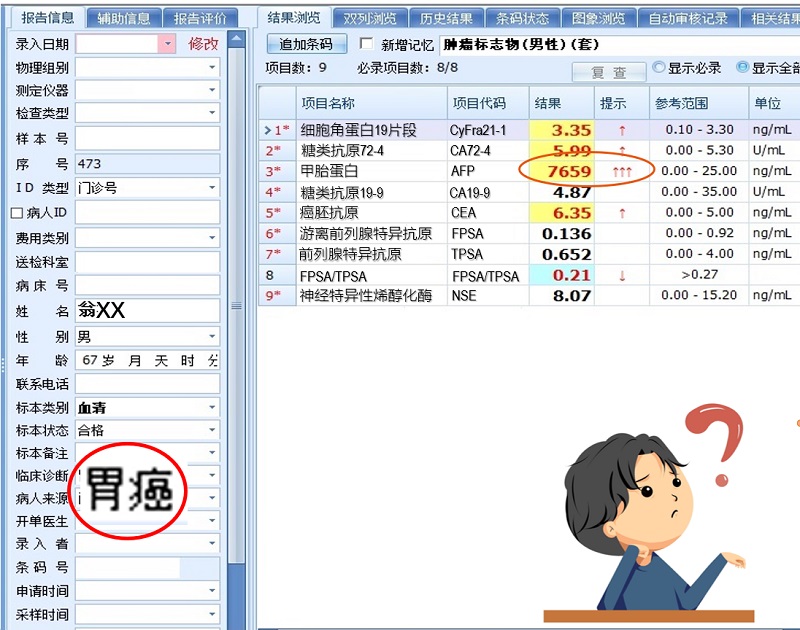
我查看了患者的病历得知:患者是一名老年男性,因反复上腹部疼痛于当地医院就诊,通过CT影像学和胃镜活检,初步诊断为胃底腺癌,遂转诊于我院,在我院完善检查,首次就诊查:AFP 908 ng/ml,CEA 9.36 ng/ml,ALT 16mmol/L,AST 20mmol/L,乙肝表面抗原HbsAg(-);CT影像学提示:符合胃癌病变伴淋巴结的转移;腹部影像学检查:无肝炎、肝硬化、肝占位等影像。无喝酒史、吸烟史。根据以上的简要病史和检查,不支持患者有肝脏相关的疾病以及生殖细胞恶行肿瘤的可能,那么这个胃癌患者AFP原因是什么呢?
为了深究这个问题,我回顾了患者整体病程相关的治疗和相关指标:
2019-06-14首诊时,已诊断胃底腺癌。患者相关检查并不支持肝的疾病,但AFP 908 ng/ml是一个较高的水平,CEA 9.36 ng/ml超过正常水平的上限轻微上升。
2019-06-19、2019-07-10患者行2程新辅助化疗(奥沙利铂+替吉奥),复查CT影像上提示,病灶和转移淋巴结稍缩小。但复查肿瘤标志物发现AFP不仅没有下降反而上升, AFP升高到1580 ng/ml,CEA 7.85 ng/ml,较前稍下降。
2019-08-02患者行“腹腔镜下贲门癌根治术”,病理结果示:低分化腺癌,肠型。
2019-12-23术后复查肿瘤标志物AFP降至正常范围内,AFP 10.58 ng/ml。CEA 6.99 ng/ml与前变化不大。继续奥沙利铂、替吉奥化疗方案治疗
2020-10-26患者已行8程化疗,复查评估疗效为PD,并新发胰腺体部和尾部转移瘤的转移灶。此时,患者的AFP 371.1 ng/ml,已呈升高趋势,而CEA 6.05 ng/ml还是变化不大。由于出现腹腔转移,遂更换化疗方案继续治疗。
2021-05-11新方案治疗4程后,复查发现腹膜,网膜,肠系膜多发种植转移。AFP 7659 ng/ml,达到了新高度,CEA 6.05 ng/ml还是变化不大。并根据随访,患者在两个月后因疾病急速进展在当地病逝。
病程中AFP、CEA动态变化如下图(参考范围:AFP 0~25ng/ml、CEA 0~5ng/ml):
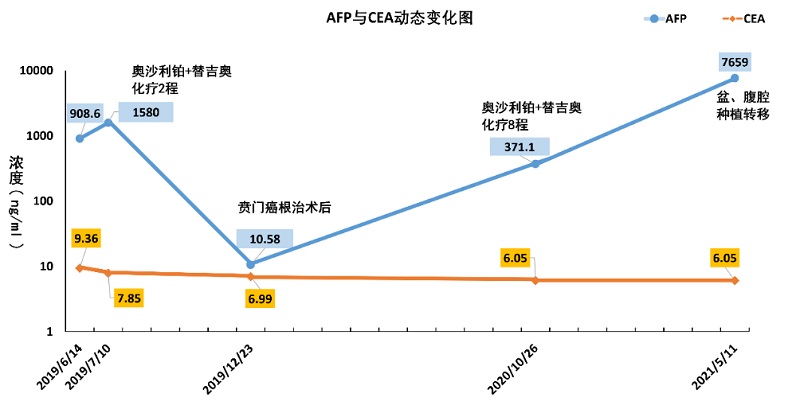
通过整个病程的回顾,我们可以清楚的看到患者的AFP水平与患者的治疗效果、病情复发密切相关。那是不是真的存在与AFP相关的胃癌呢?
通过查阅大量的中外的文献报道,发现真的有一种胃癌会产生AFP!这种胃癌被称为AFP阳性胃癌。最早在1970年被首次报道。
AFP阳性胃癌(AFPGC)的定义是在排除其他可能产生AFP的疾病后,经病理学证实合并血清AFP升高的胃癌。发生率大概是1.3~15%,亚型常分为肝样腺癌,胃肠型,卵黄囊型及混合型,最常见的是肝样腺癌,在组织病理学形态上可以看到肝样分化区,且病灶中免疫组化AFP强阳性。而在本案例中,患者病理结果为:低分化腺癌,肠型。经过与病理科医生沟通后,考虑该患者可能是更为罕见的胃肠型AFPGC。AFPGC的特点多发于老年男性,与普通胃癌相比更易转移,疾病进展快,预后差。综上所述的特点,与本案例的患者病情变化特点相符。
有学者提出高水平AFP是AFPGC预后的独立危险因素,相比普通胃癌,AFPGC更易发生腹膜后淋巴结转移、肝转移、脉管侵犯,术后出现肝转移的时间较短(2-11个月);即使是早期胃癌,出现AFP升高,同样具有高度侵袭性,部分局限于黏膜或黏膜下的病变也可合并有淋巴结转移,预后更差。AFP水平高低与患者预后相关,研究显示,AFP < 20 ng/ml组,AFP 20-300 ng/ml组和AFP > 300 ng/ml组患者的5年生存率分别为45.8%、17.8%和7.7%。显然,监测AFP动态改变对AFPGC的预后评估有重要的价值。
那么在AFPGC中,AFP高表达的机制是什么呢?大部分的学者认为胃与肝均起源于内胚层,即胃肝具有共同的基因表型,其胚胎期细胞均能合成AFP,胃细胞癌变时,表达AFP基因上的启动子去甲基化,“沉默”的基因被重新激活,从而导致血清的AFP呈现一个高表达的水平。这一观点与本案例中患者在胃癌根治术后复查AFP下降至正常范围内这一特点相符合。因此近年来也报道过一些内胚层肿瘤也会见AFP升高的情况。
还有部分的学者认为HER2可能是调节生物标志物AFP表达的上游因子之一,具有维持胚胎干细胞多能性的调控作用,可能是导致AFP异常高表达的原因。但具体的机制还需要进一步的研究。
通过此次特殊案例的学习,我深知,学起于思,思源于疑。在日常工作中遇到的疑难问题,都应积极寻求答案,并在此过程中不断学习积累。只有这样勤学善思,才能历练自我,将所学运用于实践。保持一颗为医患服务的心,认真对待每一份检验报告,方能在检验的道路上远行。
参考文献:
[1]梁海清,王勇,纪永健,李一然.不同AFP水平的AFP阳性胃癌患者临床病理参数及预后比较分析[J].山东医药,2020,60(08):71-73.
[2]Aixia, Zhang, Bin, et al. Advanced intrahepatic cholangio-carcinoma treated using anlotinib and microwave ablation:Acase report[J]. Medicine, 2019,98(52):18435.
[3]Park SJ, Jang JY, Jeong SW, et al. Usefulness of AFP,AFP-L3, and PIVKA-II, and their combinations in diagnosing hepatocellular carcinoma [J]. Medicine,2017,96(11):5811.
[4]谢继光,闫晓晓,董永红.甲胎蛋白阳性胃癌研究现状与进展[J].中国临床研究,2019,32(12):1727-1730.
[5]Chen W, Peng J, Ye J, Dai W, Li G, He Y. Aberrant AFP expression characterizes a subset of hepatocellular carcinoma with distinct gene expression patterns and inferior prognosis. J Cancer. 2020 Jan 1;11(2):403-413.
[6]Ishikura H, Kirimoto K, Shamoto M, Miyamoto Y, Yamagiwa H, Itoh T, Aizawa M. Hepatoid adenocarcinomas of the stomach. An analysis of seven cases. Cancer. 1986 Jul 1;58(1):119-26.
[7]张佟,王文莉,叶红.CA153、CA199联合AFP检测在卵巢癌病情进展、化疗近期疗效的评估[J].分子诊断与治疗杂志,2021,13(06):956-960.
[8]余先焕,李海刚,胡俊庭,王捷,刘超.产甲胎蛋白胃癌1例[J].中国肿瘤临床, 2009,36(02):96.
[9]李士新,韩瑞瑞,张锦.甲胎蛋白阳性胃癌1例报道[J].现代医药卫生, 2021,37(02):350-352.
[10]戴伟钢,叶志君,王亮,吴晖.产极高甲胎蛋白胃癌伴同时性肝转移1例[J].消化肿瘤杂志(电子版),2016,8(03):184-187.
[11]Fujimoto M, Matsuzaki I, Nishino M, Iwahashi Y, Warigaya K, Kojima F, Ono K, Murata SI. HER2 is frequently overexpressed in hepatoid adenocarcinoma and gastric carcinoma with enteroblastic differentiation: a comparison of 35 cases to 334 gastric carcinomas of other histological types. J Clin Pathol. 2018 Jul;71(7):600-607.
[12]陈昊,沈丹平,刘佳骅,沈艳莹,倪醒之.胃肝样腺癌的临床病理特征及预后[J].广东医学,2014,35(14):2248-2251.DOI:10.13820/j.cnki.gdyx.2014.14.044.
[13] Lin HJ, Hsieh YH, Fang WL, Huang KH, Li AF. Clinical manifestations in patients with alpha-fetoprotein-producing gastric cancer. Curr Oncol. 2014;21(3):e394-e399.






