肿瘤标志案例15:肝癌术后CEA 长期维持轻度升高析因
1、题目:
肝癌术后CEA长期维持轻度升高析因
2、基本信息:
罗某,男,80岁,因肝脏肿瘤就诊于中山大学附属肿瘤医院。
3、病史简述:
患者于1998年发现患有乙型肝炎(小三阳),定期体检,2010年12月20日我院MR检查示肝占位(S4 2.5*1.9CM ),12月24日行肝癌切除术和胆囊切除术,病理结果为肝细胞癌。术后患者定期复查,至2022年无肝癌复发与转移征象,但CEA未能下降至正常参考值范围内。临床医生向检验科提出疑问:患者术后定期复查,影像学检查及体征均没有提示肿瘤进展,而七年来血清CEA结果却均超出正常参考值范围,检验结果是否准确?
4、案例追踪及随访:
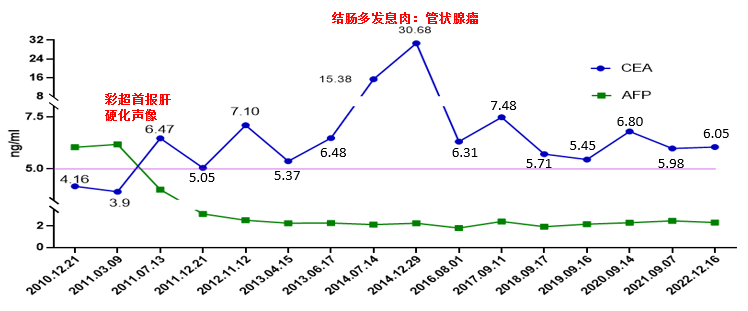
患者于2010.12.20被查出肝占位(S4 2.5*1.9cm )时(68岁)血清CEA 4.16ng/ml,AFP 6.04 ng/ml,肝癌切除术后三个月复查,影像学显示肝脏S4段呈术后改变,CEA 3.90 ng/ml,AFP 6.18 ng/ml;术后半年(2011年5月10日)复查,彩超首次发现患者有肝硬化结节(S3段2个肝硬化结节,最大约1.7*1.8cm)。2011年7月13日患者CEA上升至6.47 ng/ml,患者诉说有排便次数增多,但肠镜显示患者未见异常,CT检查也未见复发征象。直至2014年7月14日,患者CEA 15.38 ng/ml,肝功能正常,腹部CT检查未见复发;2014年12月29日肠镜发现结肠多发息肉(管状-绒毛状腺瘤)时CEA 30.68 ng/ml,钳除后CEA逐渐下降至6.31 ng/ml。
接下来患者定期复查,影像学显示依然无复发和肿瘤进展,但七年来患者的CEA未能下降至正常参考值范围内,波动在5.45-7.48 ng/ml。血清CEA与AFP动态监测结果如下图:
- 案例分析及专家点评:
图示清晰地展现出:患者肝癌切除术后,血清AFP下降至正常水平,与影像学检查未见肝癌进展表现一致,但七年来CEA持续轻度升高,患者担心复发,多次影像学复查也未见任何复发或者转移的迹象,于是临床怀疑,是否CEA检测结果不准确?
我们先来了解一下癌胚抗原(CEA),它是一种可溶性糖蛋白,产生于胚胎及胎儿期,妊娠2个月后的胎儿由消化道产生并分泌,出生后逐渐降低。血清中的CEA主要通过Kupffer cell和肝细胞清除,其半衰期为1-7天[1] 。作为一种广谱肿瘤标志物,70-90%的结肠腺癌患者癌胚抗原显著升高,同时在其他多种恶性肿瘤中阳性率居高不下,包括肝癌(62-75%)、胃癌(60-90%)、胰腺癌(70-80%)、肺癌(56-80%)等[2]。我们必须清楚,出现CEA升高,我们不能武断地诊断为恶性肿瘤,因为血清CEA检测对恶性肿瘤的诊断虽然具有一定的意义,但其特异性稍差,还应考虑到引起CEA升高的非肿瘤性疾病和良性肿瘤疾病。有研究表明20%-50%的良性疾病患者中,CEA水平可有轻度增高,尤其是肠道、胰腺、肝脏及肺部疾病。在这些疾病中,CEA几乎趋于保持在病理值低限(轻度升高),很少超过10ng/ml[3]。罗某术后3年半,也即2014年7月14日,CEA突然飙升至15.38ng/ml,在钳除腺瘤后缓慢下降至6.31 ng/ml,那么肠息肉可以引起CEA升高吗?Chenchen Zhang等人回顾分析2014年5月至2021年12月期间在山东大学第二医院自愿接受结肠镜检查的无症状和健康人群的血清CEA结果得出以下结论:息肉组的CEA水平高于对照组;腺瘤组高于非腺瘤组;单发腺瘤组高于多发腺瘤组[4]。由表一也可知:结肠息肉患者,随着年龄增长CEA异常升高的患者逐渐增多 (P<0.05),70岁以上患者CEA出现异常升高的例数明显多于50岁以下及50-70岁患者 (P<0.05)。早在1985年就有学者通过免疫过氧化物酶技术证明了CEA在正常结肠粘膜中的定位[5]。O 'Brien的研究发现,62个肠道息肉中均存在CEA,并且那些表现出严重不典型增生或肿瘤变性的息肉显示更高水平的抗原表达[6]。另一项研究发现,伴随着息肉的出现,患者血清CEA水平增加,而息肉切除后CEA逐渐降低[7],本案例也是这样。所以,我们认为结肠息肉钳除前的CEA水平逐渐升高是结肠息肉引起的。
表一:结直肠息肉患者临床特征与CEA之间的关系[n(%)]
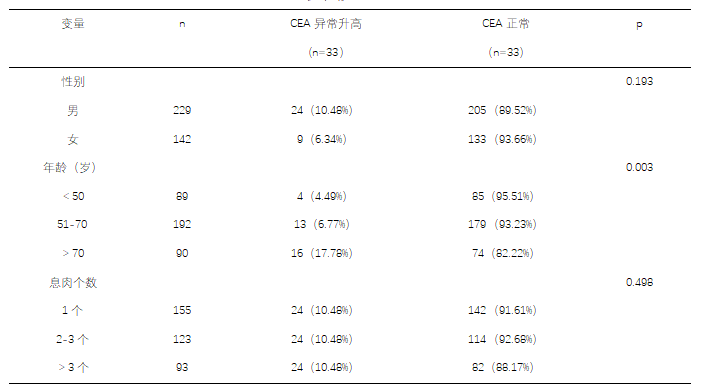
表一数据来源于:冯怡锟,蒋玉涵,刘维伟等.371例结直肠息肉患者临床特征及其与粪便隐血和血CEA之间的关系[J].重庆医学,2018,47(09):1183-1185.
患者自息肉钳除术血清AFP持续正常,近七年来CEA虽然高于正常参考值上限,但稳定在轻度升高的水平,没有持续升高,尤其是影像学及体征均稳定,可以排除肿瘤进展。吸烟也会影响CEA水平,在男性受试者中,吸烟者的血清CEA水平(3.11±1.8 ng/ml)明显高于非吸烟者(2.14±1.8 ng/ml)(平均值±SD; p<0.01)[8],本例患者无吸烟史,也排除了吸烟引起的CEA升高。罗某就诊时已经68岁,七年前75岁,那么年龄是否是引起CEA升高的原因呢?一项关于1481例男性CEA变化规律的研究发现,CEA随年龄增高有上升趋势,男性从2l岁至95岁,其CEA逐渐上升,在7l岁以上有明显的增高(P<0.01),具体见表二。这一结论在国外文献也得到证实[9],详见表三。
表二:健康对照组CEA 数据统计描述 (单位:μg/L)
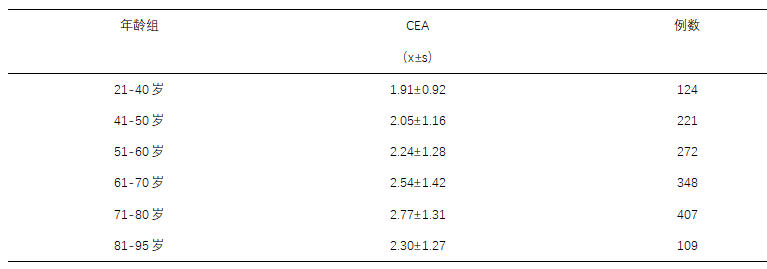
多组间分析有显著性差异的如下:CEA P=0.000;Dunnett T3法进行两两比较21-40岁组与71-80岁组 p=0.000;21-40岁组与81-95岁组 p=0.000;41-50岁组与71-80岁组 p=0.000;41-50岁组与81-95岁组 p=0.000;51-60岁组与81-95岁组 p=0.036;61-70岁组与71-80岁组 p=0.006;61-70岁组与81-95岁组 p=0.007。
表二数据来源于:刘瑾, 王兰兰, 蔡蓓, 李佳琦, & 阳红. (2006). 1481例男性正常人血清甲胎蛋白、癌胚抗原以及总前列腺特异性抗原95%参考值范围的确定. 华西医学, 21(3), 2.
表三: The age-dependent and sex-dependent RIs of the four tumor markers and the 90% confidence intervals.
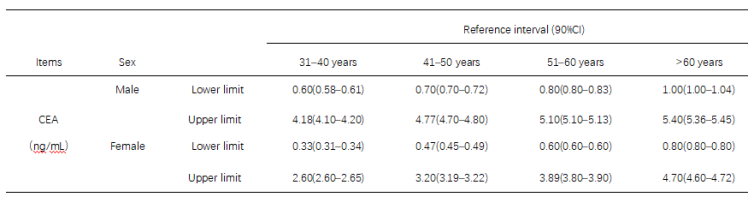
尽管随年龄增高,血清CEA有上升趋势,但文献资料的数据显示,70到80岁组男性CEA90%可信区间的上限水平并没有突破6.0ng/ml,显然年龄因素在本例患者CEA增高的贡献不大。
让我们继续回顾罗某的血清CEA动态监测图,在彩超首次报道罗某肝硬化声像后,CEA结果6.47 ng/ml,近七年来多次的影像检查均显示肝硬化结节较前无明显变化,CEA结果与影像结果一致,持续稳定在5.45-7.48 ng/ml之间,波动均值为6.28ng/ml。另一个有力证据是结肠息肉钳除术时CEA最高浓度为30.68ng/ml,而CEA的半衰期为5天,根据理论测算,钳除术后约15天后CEA即可恢复正常,但实际情况是息肉钳除术后半年CEA数值依然为6.31ng/ml,非常接近波动均值,说明一直有肿瘤除外的其他因素导致CEA的水平升高。据文献报道,肝硬化患者的CEA水平可轻至中度升高(见下表四),特别是老年(年龄范围60-81岁)肝硬化组,差别有统计学差异,肝硬化组的CEA均值8.18,水平介于6.73-9.63ng/ml之间,稍高于本例患者的CEA水平波动区间。
表四:肝硬化组和对照组的CEA结果(x±s)比较

*男性70例,女性46例,年龄范围60-81岁。
表四数据来源于:郭治伟,梁雪妮,刘志轩,孙世忠.肿瘤标志物检测对老年肝硬化患者的临床诊断价值[J].中华老年多器官疾病杂志,2021,20(02):127-131.
血清中的CEA主要通过Kupffer cell和肝细胞清除,肝脏对 CEA 的代谢及排泄至关重要[1],如果肝脏受损伤,如肝硬化时,肝细胞外基质中形成纤维的胶原蛋白的过度合成和沉积,导致结节形成和正常结构的丧失,会引起CEA清除速度减慢,血清CEA 水平反应性升高[10]。
经过对各种因素逐步分析,很显然,肝硬化是导致罗某血清CEA水平长期轻度升高的主要原因。
作 者:李林芳 中山大学肿瘤防治中心 检验科
点评专家:戴淑琴 中山大学肿瘤防治中心 检验科
参考文献:
1. Loewenstein, M. S. ;Zamcheck, N., Carcinoembryonic antigen (CEA) levels in benign gastrointestinal disease states. Cancer 1978, 42(3Suppl), 1412-8.
2. Ballesta, A. M.; Molina, R.; Filella, X.; o, J.; Giménez, N., Carcinoembryonic antigen in staging and follow-up of patients with solid tumors. Tumour Biol 1995, 16 (1), 32-41.
3. Ruibal Morell, A., CEA serum levels in non-neoplastic disease. Int J Biol Markers 1992, 7 (3), 160-6.
4. Zhang, C.; Wang, Y.; Zhu, K.; Wang, X.; Yu, W.; Li, S., Predictors for Colorectal Polyps in an Asymptomatic Population Undergoing Medical Check-ups. Surg Laparosc Endosc Percutan Tech 2023, 33 (2), 108-114.
5. Amanti, C.; Midiri, G.; Benedetti, M.; Campisi, C.; Di Tondo, U.; Castagna, G.; Peronace, L.; Santeusanio, G.; Di Paola, M., Tissue CEA detection by immunoperoxidase (PAP) test in colorectal polyps: correlations with the degree of dysplasia. J Surg Oncol 1985, 28 (3), 222-6.
6. O'Brien, M. J.; Kirkham, S. E.; Burke, B.; Ormerod, M.; Saravis, C. A.; Gottlieb, L. S.; Neville, A. M.; Zamcheck, N., CEA, ZGM and EMA localization in cells of pleural and peritoneal effusion: a preliminary study. Invest Cell Pathol 1980, 3 (3), 251-8.
7. Krush, A. J.; Zamcheck, N.; Lynch, H. T., CEA and genetics. Gardner's syndrome. Dis Colon Rectum 1983, 26 (6), 404-8.
8. Fukuda, I.; Yamakado, M.; Kiyose, H., Influence of smoking on serum carcinoembryonic antigen levels in subjects who underwent multiphasic health testing and services. J Med Syst 1998, 22 (2), 89-93.
9. Yu, H., Reference intervals for gastrointestinal tumor markers (AFP, CEA, CA199 and CA724) in healthy adults of Han nationality in Chongqing by Roche ECLIA system. Scand J Clin Lab Invest 2019, 79 (7), 484-490.
10. George, J.; Tsuchishima, M.; Tsutsumi, M., Metabolism of N-nitrosodimethylamine, methylation of macromolecules, and development of hepatic fibrosis in rodent models. J Mol Med (Berl) 2020, 98 (9), 1203-1213.






