儿童ALL新进展——2019ASH速递
中山大学肿瘤防治中心 许艳洁综述 孙斐斐审校
急性淋巴细胞白血病(ALL)是儿童恶性肿瘤性疾病中常见的类型,总体生存率(OS)>90%,但仍有10%-20%的高危患儿会复发,虽然目前对于复发难治患儿的治疗手段层出不穷,但依旧有部分患者效果不佳。针对上述问题,今年的ASH会议在儿童ALL方面又取得部分进展。
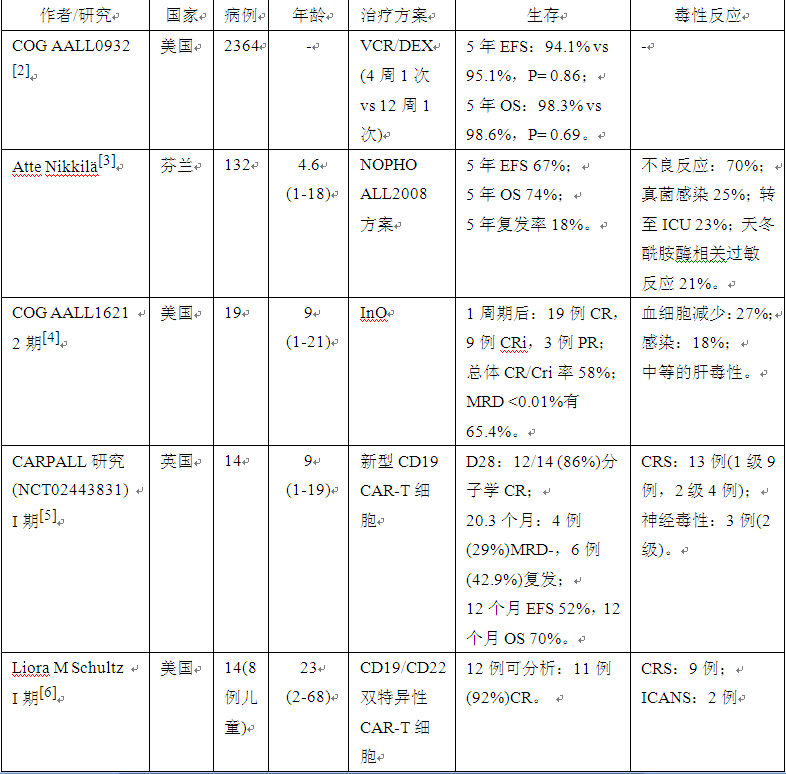
在预测指标方面,传统的核型分析和RT-PCR只能识别B-ALL患儿50%的基因异常,新加坡国立大学医院儿科团队通过对377例儿童ALL患者的骨髓或外周血标本进行RNA测序[1],共获得了20种独特的亚型,再将这些亚型分为4组,低危组(66%)、中危组(15%)、高危组(12%)和其他(7%)。和传统危险分层(结合细胞遗传学、DNA指数和融合基因)相比,RNA测序-低危组患者生存时间更长(OS, 99.1% vs 98.2%),RNA-测序-高危组患者生存时间更短(OS, 74.7% vs 75.4%)。在COX比例风险回归中,仅有RNA测序的危险度分层是影响患者OS的独立危险因素(高危:低危 P=3.4×10-4,高危:中危 P=0.27)。
有2个研究探索单纯化疗在儿童ALL中的作用。儿童肿瘤学组(COG)AALL0932研究将2364例患儿从维持治疗开始时分为2组,组1每4周使用1次长春新碱/地塞米松(VCR/DEX),组2每12周使用1次VCR/DEX。结果显示组1患儿5年无病生存(EFS)和OS分别为94.1%和98.3%,组2为95.1%和98.6%,2组间EFS和OS差别均不大,提示对于ALL患儿的维持治疗可以适当降低频率。北欧合作组致力于探究高危儿童ALL患者的治疗方案。共有132例高危ALL患儿被纳入该研究,所有患儿均使用强化化疗方案,首先是3药诱导治疗(VCR+DOX+ PRED/DEXA),然后为9或7周期的block,接着序贯以60周6MP/MTX和HD-MTX临时维持治疗,其次是再诱导治疗,最终维持治疗至诊断后2.5年。该研究中患儿5年EFS为67%,OS为74%,复发率为18%。研究还发现该方案对存在KMT2A重排且EOI MRD<0.1%的患者尤其出色,这些患者在随访期内均未复发,由于药物毒性导致5年EFS为80% (95% CI 55-100%),未来该类患者可以考虑降低化疗强度。
也有研究展示了靶向药物在儿童ALL中的应用。奥英妥珠单抗(InO)是一种CD22抗体-药物偶联物,已被比准用于成人复发/难治ALL患者。COG AALL1621的2期临床实验则将其用于复发难治的CD22+B-ALL患儿。48例中位年龄9岁(1-21)的患儿在第8天和第15天分别使用0.8mg/m2和0.5mg/m2的InO治疗。1周期后19例患者达到了完全缓解(CR),9例达到了骨髓缓解(Cri),总体缓解率为58%;65.4%的患者达到了微小残留病变(MRD)
CAR-T细胞治疗儿童ALL近年来越发受人关注,单靶点的CD19或CD22 CAR-T细胞在复发难治ALL患儿中的缓解率可达70%-90%。今年的ASH有2项研究关注了CAR-T疗法在儿童ALL中的作用。英国伦敦儿童健康研究所的研究使用了具有快速关闭率的新型CD19 CAR-T (CAT-41BBz CAR)细胞治疗骨髓肿瘤负荷低的儿童B-ALL,CAR-T细胞剂量为1x10 6个细胞/kg,与以往的 CAR-T细胞相比,新型CAR-T细胞在体内的持续时间延长(214.5d vs 196d),细胞峰值升高(128 911/ug vs 47 988/ug)。在回输28天后,12/14 (86%) 患者达到了分子学CR。当中位随访时间达20.3个月时,有4例(29%)患者的MRD阴性,6例复发,12个月EFS为52%,OS为70%。斯坦福大学医学院Liora M Schultz教授团队则对14例受试者(8名儿科患者,6名成人)使用了CD19/CD22双特异性CAR-T细胞,剂量水平1(1x10 6个细胞/ kg)7例,剂量水平2(3x106个细胞/kg)7例。当中位随访时间为9.5个月时,12例患者中有11例(92%)达到了CR,其中10例在第28天获得了CR,1例在第28天获得了PR,但出现髓外病变,到180天时该患者未经其他干预也达到了CR。
今年的ASH会议在儿童ALL的预测,单纯化疗,靶向治疗和CAR-T细胞治疗上都有值得进一步期待的进展,为ALL患儿未来的治疗选择提供了新的方向和策略。
表1 儿童ALL治疗方案
参考文献:
[1] RNA Sequencing in Childhood B-Lymphoblastic Leukemia Improves Molecular and Risk Assignment. https://ash.confex.com/ash/2019/webprogram/Paper131653.html.
[2] Excellent Outcomes with Reduced Frequency of Vincristine and Dexamethasone Pulses in Children with National Cancer Institute (NCI) Standard-Risk B Acute Lymphoblastic Leukemia (SR B-ALL): A Report from Children’s Oncology Group (COG) Study AALL0932. https://ash.confex.com/ash/2019/webprogram/Paper123565.html.
[3] Intensive Chemotherapy for High-Risk ALL in Children – the Nordic Collaborative Approach. https://ash.confex.com/ash/2019/webprogram/Paper122914.html.
[4] A Phase 2 Trial of Inotuzumab Ozogamicin (InO) in Children and Young Adults with Relapsed or Refractory (R/R) CD22+ B-Acute Lymphoblastic Leukemia (B-ALL): Results from Children's Oncology Group Protocol AALL1621. https://ash.confex.com/ash/2019/webprogram/Paper128977.html.
[5] Therapy of Paediatric B-ALL with a Fast Off Rate CD19 CAR Leads to Enhanced Expansion and Prolonged CAR T Cell Persistence in Patients with Low Bone Marrow Tumour Burden, and Is Associated with a Favourable Toxicity Profile. https://ash.confex.com/ash/2019/webprogram/Paper125009.html.
[6] Phase I Trial Using CD19/CD22 Bispecific CAR T Cells in Pediatric and Adult Acute Lymphoblastic Leukemia (ALL). https://ash.confex.com/ash/2019/webprogram/Paper129411.html.






