李斌奎团队揭示肝癌免疫治疗抵抗新机制
2025年9月18日,中山大学肿瘤防治中心肝脏外科李斌奎团队在《美国科学院院刊》(PNAS)在线发表了题为“USP14-mediated metabolic competition impairs CD8+ T cell immunosurveillance in hepatocellular carcinoma”的研究论文。该研究揭示泛素特异性蛋白酶USP14是肝癌免疫治疗耐药的关键调控基因,可作为预测肝癌免疫治疗疗效的生物标志物和克服肝癌免疫治疗耐药的潜在治疗靶点。这一研究成果对提升肝癌免疫治疗的疗效、优化临床治疗策略及推进个体化治疗具有重要价值。

近年来肿瘤免疫治疗的迅猛发展为肝癌治疗带来了全新的理念与方法,特别是以免疫检查点抑制剂PD-1/PD-L1抗体为代表的免疫治疗为肝癌患者提供了新的希望。免疫治疗具有持久反应的潜力,但由于原发性耐药只有约20%的肝癌患者从免疫治疗中受益,且部分响应的患者者最终仍会发生获得性耐药。因此,深入探究限制免疫治疗疗效的关键因素、阐明其分子机制、寻找有效联合靶点,对提升肝癌整体治疗水平具有重要临床意义。CD8+ T细胞是免疫治疗的核心效应细胞,但肝癌细胞可通过多种途径重塑免疫微环境进而抑制CD8+ T细胞的浸润与功能,最终逃避免疫攻击。因此探索肝癌细胞交互调控CD8+ T细胞敏感性的机制,是克服免疫治疗耐药的可能突破口。
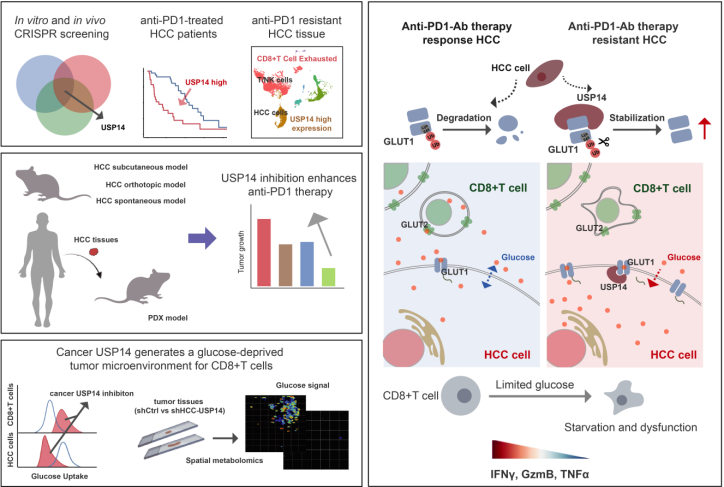
该研究整合小鼠及人源全基因组CRISPR-Cas9敲除文库、CRISPR-dCas9激活文库筛选体系,在体内外系统性筛选肝癌细胞中影响CD8+T细胞免疫监视的关键基因。通过筛选数据、文献检索、临床资料以及单细胞测序验证分析等多组学分析,研究锁定肿瘤细胞中的USP14是驱动肝癌免疫逃逸的重要因子。临床相关性分析显示,USP14高表达患者对抗PD-1治疗反应较差,且肿瘤中CD8+ T细胞浸润显著减少。在共培养实验中,抑制USP14可有效恢复CD8+ T细胞的细胞毒性,并抑制肝癌细胞增殖。动物实验进一步证实,靶向USP14与抗PD-1治疗联用表现出显著的协同抗肿瘤效果。
在机制层面,研究团队发现USP14通过去泛素化修饰葡萄糖转运蛋白GLUT1(去除GLUT1蛋白Lys-245位点的Lys-48多聚泛素链),增强其稳定性并促进葡萄糖摄取。这一过程导致肝癌细胞在代谢上“抢夺”葡萄糖,造成肿瘤微环境中的葡萄糖匮乏,从而抑制CD8+T细胞的代谢活性和功能。利用患者来源类器官和人源肿瘤异种移植模型,研究者证实无论通过药理学抑制还是遗传沉默USP14,均可重塑CD8+T细胞的代谢状态,并显著增强抗PD-1治疗的疗效。
该研究不仅系统阐明了USP14通过GLUT1介导的葡萄糖竞争机制促进免疫逃逸的作用途径,还从分子、细胞、动物及临床多个层面证实其作为生物标志物和治疗靶点的潜力。研究成果为肝癌免疫治疗提供了新的生物标志物和联合治疗策略,有望为逆转免疫耐药、提升治疗响应率提供新的思路。
研究示意图
中山大学肿瘤防治中心李斌奎教授为本研究的独立通讯作者。中山大学肿瘤防治中心元一川医生、牛艺副研究员、黄振坤医生为本研究的共同第一作者。
论文链接:https://doi.org/10.1073/pnas.2510576122
来源:肝脏外科
文:元一川






